曲霉半乳甘露聚糖(GM)检测,主要适用于侵袭性曲霉病(IA)的早期诊断。菌丝生长时GM从薄弱的菌丝顶端释放,是IA最早释放的抗原之一。血清与肺泡灌洗液(BALF)GM检测对IA的诊断具有重要价值,可实现IA的早期快速诊断。然而,GM试验存在一定的干扰因素,常见的GM假阳性因素主要有:(1)β-内酰胺类抗生素;(2)交叉反应(如组织胞浆菌、镰刀菌、隐球菌、芽生菌病等);(3)血液制品;(4)新生儿双歧杆菌定植;(5)其他因素等。现将GM检测的假阳性和假阴性干扰因素总结如下:

1) β-内酰胺类抗生素(包括含有酶抑制剂的抗生素)
A.血清样本
关于哌拉西林/他唑巴坦(TZP)引起的GM假阳性研究有很多。哌拉西林是青霉的发酵产物,青霉细胞壁中含有GM[1]。2003年首次报道的研究发现患者使用的四批次TZP中含有GM [2]。2018年的一项研究对三个国家(PiSATM,墨西哥;VitalisTM,哥伦比亚; PfizerTM,美国)生产的TZP进行了GM检测,结果发现只有墨西哥公司生产的TZP出现了假阳性,同时对本公司生产的阿莫西林、双氯西林、头孢曲松、头孢噻吩药品进行GM试验检测,均未出现假阳性[3]。目前,有证据表明世界各地(美国,意大利,巴西、美国、韩国)TZP配方已不再与GM试验的假阳性相关。但是,一些国家(法国和土耳其)TZP配方仍然存在问题[4-9]。在中国TZP的配方是否还存在问题,目前尚不清楚。
阿莫西林/克拉维酸(AMC)是另一种被认为可引起血清GM试验假阳性的抗生素,2004年首次报道了一例55岁的女性肺炎患者,从2004年2月2日至2月13日每日三次静脉注射 AMC预防治疗。结果发现GM检测值从2月3日的0.06升到2月5日的4.01,在 2月12日增加到6.1 [10]。
此外,其他抗生素也有可能引起GM试验假阳性。2010年的一项研究报道了不同抗生素引起血清GM试验的假阳性研究。结果发现不同抗生素血清样本GM试验的假阳性分别是AMC(26.7%,4/15),TZP (58.3%,7/12),头孢吡肟(CFP)(14.3%,1/7),头孢哌酮/舒巴坦(CPZ-SB)(66.7%,2/3)[11],如图1。
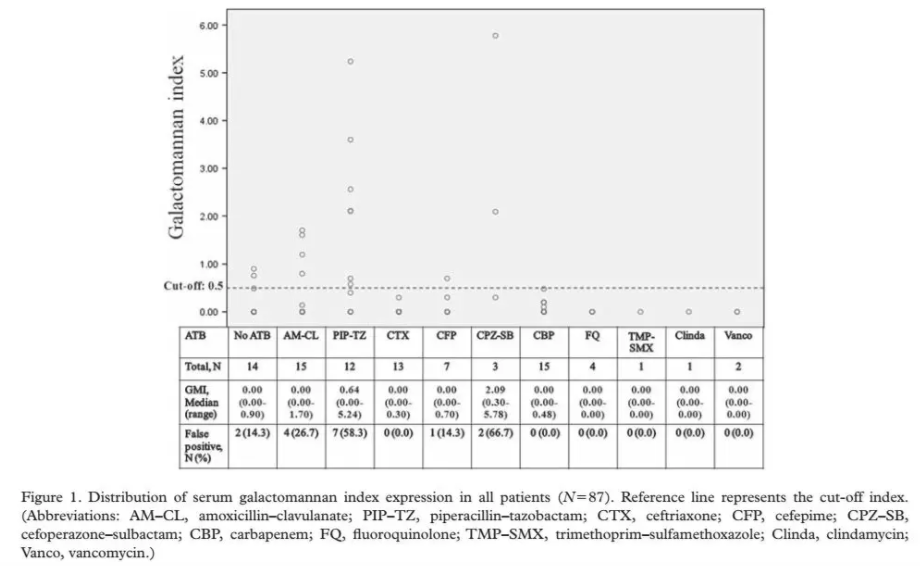
图1 所有患者血清半乳甘露聚糖的指数和分布(N=87)。
缩写:AM-CL,阿莫西林-克拉维酸;PIP-TZ,哌拉西林-他唑巴坦;CTX,头孢曲松;CFP,头孢吡肟;CPZ-SB,头孢哌酮-舒巴坦;CBP,碳青霉烯类;FQ,氟喹诺酮;TMP-SMX,甲氧苄氨嘧啶-磺胺甲恶唑; Clinda,克林霉素;Vanco,万古霉素
B.肺泡灌洗液(BALF)样本
对于BALF GM的假阳性因素研究较少,目前有报道的主要有抗生素的使用以及灌洗液本身引起。
2010年研究报道了不同抗生素引起BALF GM检测的假阳性研究。结果发现不同抗生素BALF样本GM检测的假阳性分别是AMC(27.3%,3/11),TZP (50%,4/8),头孢吡肟(CFP)(16.7%,1/6),头孢曲松(CTX)(45.5%,5/11),碳青霉烯类(CBP)(45.5%,5/11)如图2[11]。但是目前抗生素对BALF GM的影响仍需近一步的研究确认。
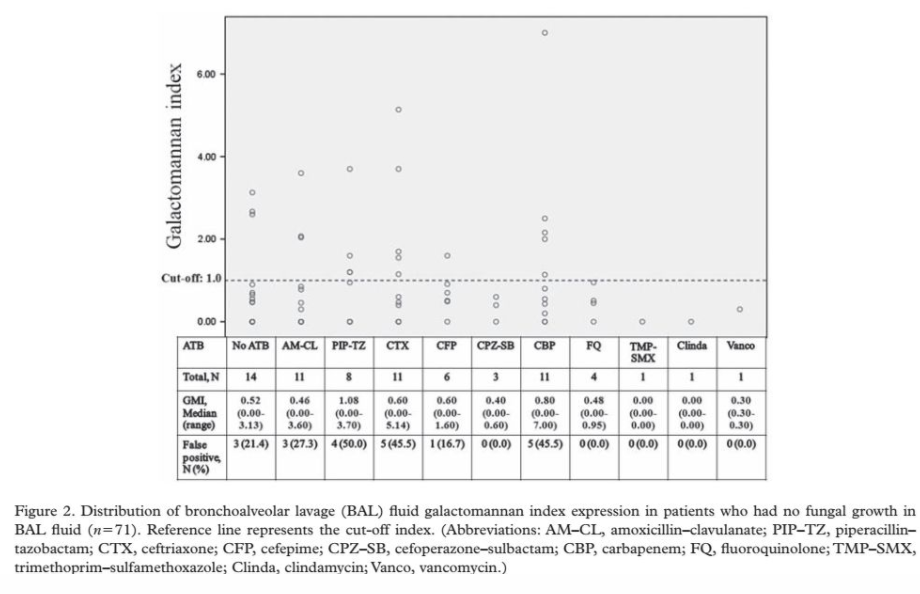
图2 所有患者BALF指数和分布(N=71)。
缩写:AM-CL,阿莫西林-克拉维酸;PIP-TZ,哌拉西林-他唑巴坦;CTX,头孢曲松;CFP,头孢吡肟;CPZ-SB,头孢哌酮-舒巴坦;CBP,碳青霉烯类;FQ,氟喹诺酮;TMP-SMX,甲氧苄氨嘧啶-磺胺甲恶唑;Clinda,克林霉素;Vanco,万古霉素。
葡萄糖酸盐的勃脉力(Plasmalyte)溶液,其生产是由葡萄糖在霉菌发酵产生。勃脉力可作为水、电解质的补充源和碱化剂。加入正在输注的血液组分或作为血细胞的稀释液。研究表明,采用含葡萄糖酸盐的勃脉力溶液进行BALF采集会出现GM检测假阳性,如图3所示。

图3 样本的GM检测
2) 交叉反应
2019年最新的研究报道肺隐球菌患者隐球菌荚膜多糖与血清GM存在交叉反应。29例肺隐球菌病患者,其中16例(55.2%)患者血清GM高于cut off 值。在隐球菌病治疗后,GM值显著下降[12]。
2012年的研究报告4例组织胞浆菌感染的实体器官移植患者,其血清或BALF出现了GM试验的假阳性结果。与此同时,在曲霉阳性标本中也可以检测组织胞浆抗原,从2007年1月至2010年12月,2432例曲霉GM检测阳性患者,对其中的514例(21%)进行了组织胞浆菌抗原检测,其中27例为GM检测阳性[13]。
2012年的一项研究共11例患者,其中 8例为血液系统恶性肿瘤确诊为播散性镰刀菌感染,另外三名是中性粒细胞减少可能的镰刀菌感染患者,这11例患者中有9例出现GM检测阳性[14]。 值得注意的是,不同厂商的GM试剂盒使用的标记捕获抗体不同,可能导致交叉反应也不同,以上交叉反应研究结果是基于伯乐(Bio-Rad)的GM试剂盒。
3) 血液制品
2012年的一项研究收集8例非曲霉感染患者的血清样本,接受血小板输注前(输注前6小时)和血小板输注后(在完成输注后30分钟内)进行GM检测。结果发现血小板输注前GM检测的中值为0.20,所有接受血小板输注后GM中值为1.54,为阳性,如图4[15]。同时,输入免疫球蛋白也可能造成GM假阳性。
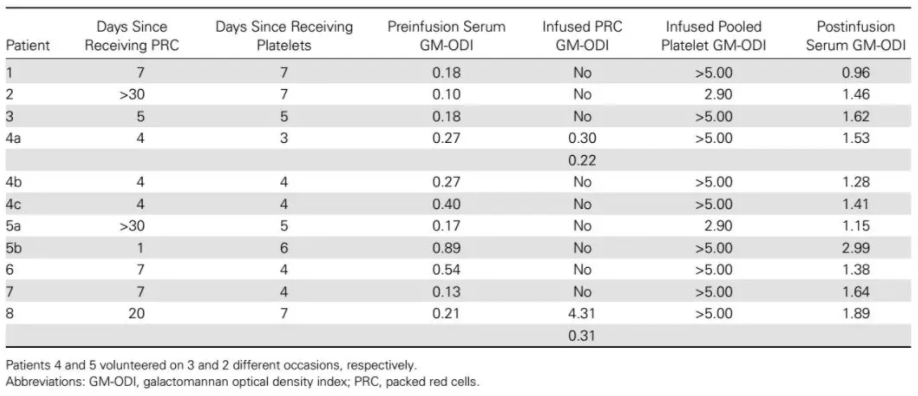
图4 未感染患者的输血前和输血后半乳甘露聚糖水平
4) 新生儿双歧杆菌定植
研究发现,双歧杆菌属是人类正常胃肠道微生物群落,占成人总粪便微生物群的6%,在母乳喂养和配方奶粉喂养婴儿的粪便微生物菌群分别占到91%和75%[16, 17]。研究表明新生儿粪便均显示GM与双歧杆菌数量相关。由于人体肠道中存在高浓度的双歧杆菌,这些细菌或排泄的脂多糖可能导致特别是新生儿血清GM检测阳性[18]。
5) 其它因素
还有一些特殊的发现,如棉签包裹的脑活检组织,GM检测出现假阳性结果。将干净的棉签灌洗样品进行GM检测出现阳性结果。这表明与GM产生交叉反应的表位存在与棉花中[19]。另外,有实验室报道,当收集血清的EP管没有保管好,被纸盒等污染也会出现GM检测假阳性,这些问题都应该尽量避免[20]。

在动物模型中证明两性霉素B的预防性给药可阻断半乳甘露聚糖和菌丝体生长的表达[15,20,31]。
研究表明,在诊断曲霉菌病前2周内给予伊曲康唑或两性霉素B制剂预防性和经验性抗真菌治疗,结果发现曲霉的敏感性降低至20%以下,如图5所示。
2000年报告了一例慢性肉芽肿病患者,其患有侵袭性肺曲霉病和膈下脓肿。治疗期间,在脓肿中能检测到高水平的曲霉抗原,但在血清中检测不到循环抗原和曲霉DNA。
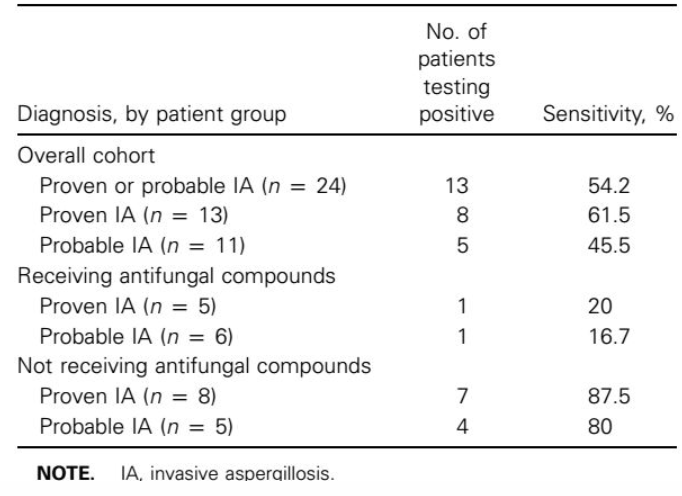
图5 GM检测敏感性
综上所述,应尽量规避对GM检测可能产生的干扰因素。针对新入科室高度怀疑的曲霉感染患者应尽早进行血清GM的筛查,减少治疗过程中因输注血液制品和抗生素治疗后产生的干扰因素;对高度怀疑的曲霉感染患者建议治疗过程中进行GM连续检测,避免单次检测的不准确性;针对预防给药后仍高度怀疑的曲霉感染患者血清GM检测阴性,则可考虑BALF GM和曲霉IgG抗体检测,提高检测的敏感性。
【参考文献】
1. Aubry A, Porcher R, Bottero J, Touratier S,Leblanc T, Brethon B, et al. Occurrence and kinetics of false-positiveAspergillus galactomannan test results following treatment with beta-lactamantibiotics in patients with hematological disorders. Journal of clinicalmicrobiology 2006; 44: 389-94.
2. Sulahian A, Touratier S, Ribaud P. Falsepositive test for aspergillus antigenemia related to concomitant administrationof piperacillin and tazobactam. The New England journal of medicine 2003; 349:2366-7.
3. Ortiz-Brizuela E, Rangel-Cordero A,Ponce-de-Leon A, Sierra-Madero J. False-positive results in the galactomannanPlatelia Aspergillus assay with generic piperacillin/tazobactam. Revistaiberoamericana de micologia 2019; 36: 51-2.
4. Demiraslan H, Atalay MA, Eren E, Demir K,Kaynar L, Koc AN, et al. Assessing the risk of false positive serumgalactomannan among patients receiving piperacillin/tazobactam for febrileneutropenia. Medical mycology 2017; 55: 535-40.
5. Gerlinger MP, Rousselot P, Rigaudeau S,Billon C, Touratier S, Castaigne S, et al. False positive galactomannanPlatelia due to piperacillin-tazobactam. Medecine et maladies infectieuses2012; 42: 10-4.
6. Ko JH, Peck KR, Lee WJ, Lee JY, Cho SY, HaYE, et al. Generic piperacillin/tazobactam is not associated with galactomannanfalse-positivity in adult patients with cancer: a case-control study. Europeanjournal of clinical microbiology & infectious diseases : officialpublication of the European Society of Clinical Microbiology 2015; 34: 1437-41.
7. Mikulska M, Furfaro E, Del Bono V, RaiolaAM, Ratto S, Bacigalupo A, et al. Piperacillin/tazobactam (Tazocin) seems to beno longer responsible for false-positive results of the galactomannan assay.The Journal of antimicrobial chemotherapy 2012; 67: 1746-8.
8. Vergidis P, Razonable RR, Wheat LJ, Estes L,Caliendo AM, Baden LR, et al. Reduction in false-positive Aspergillus serumgalactomannan enzyme immunoassay results associated with use ofpiperacillin-tazobactam in the United States. Journal of clinical microbiology2014; 52: 2199-201.
9. Xavier MO, Pasqualotto AC, Aquino VR,Sukiennik TC, Severo LC. Galactomannan detection from piperacillin-tazobactambrands available in the Brazilian market. The Brazilian journal of infectiousdiseases : an official publication of the Brazilian Society of InfectiousDiseases 2009; 13: 353-5.
10. Mattei D, Rapezzi D, Mordini N, Cuda F, LoNigro C, Musso M, et al. False-positive Aspergillus galactomannan enzyme-linkedimmunosorbent assay results in vivo during amoxicillin-clavulanic acidtreatment. Journal of clinical microbiology 2004; 42: 5362-3.
11. Boonsarngsuk V, Niyompattama A,Teosirimongkol C, Sriwanichrak K. False-positive serum and bronchoalveolarlavage Aspergillus galactomannan assays caused by different antibiotics.Scandinavian journal of infectious diseases 2010; 42: 461-8.
12. Takazono T, Saijo T, Ashizawa N, Oshima K,Nishimura K, Tashiro M, et al. Clinical features and cause analysis of falsepositive results of Aspergillus galactomannan assay in pulmonary cryptococcosispatients. European journal of clinical microbiology & infectious diseases :official publication of the European Society of Clinical Microbiology 2019; 38:735-41.
13. Vergidis P, Walker RC, Kaul DR, Kauffman CA,Freifeld AG, Slagle DC, et al. False-positive Aspergillus galactomannan assayin solid organ transplant recipients with histoplasmosis. Transplant infectiousdisease : an official journal of the Transplantation Society 2012; 14: 213-7.
14. Tortorano AM, Esposto MC, Prigitano A,Grancini A, Ossi C, Cavanna C, et al. Cross-reactivity of Fusarium spp. in theAspergillus Galactomannan enzyme-linked immunosorbent assay. Journal ofclinical microbiology 2012; 50: 1051-3.
15. Martin-Rabadan P, Gijon P, Alonso FernandezR, Ballesteros M, Anguita J, Bouza E. False-positive Aspergillus antigenemiadue to blood product conditioning fluids. Clinical infectious diseases : anofficial publication of the Infectious Diseases Society of America 2012; 55:e22-7.
16. Harmsen HJ, Wildeboer-Veloo AC, Raangs GC,Wagendorp AA, Klijn N, Bindels JG, et al. Analysis of intestinal floradevelopment in breast-fed and formula-fed infants by using molecularidentification and detection methods. Journal of pediatric gastroenterology andnutrition 2000; 30: 61-7.
17. Requena T, Burton J, Matsuki T, Munro K,Simon MA, Tanaka R, et al. Identification, detection, and enumeration of humanbifidobacterium species by PCR targeting the transaldolase gene. Applied andenvironmental microbiology 2002; 68: 2420-7.
18. Mennink-Kersten MA, Ruegebrink D, Klont RR,Warris A, Gavini F, Op den Camp HJ, et al. Bifidobacterial lipoglycan as a newcause for false-positive platelia Aspergillus enzyme-linked immunosorbent assayreactivity. Journal of clinical microbiology 2005; 43: 3925-31.
19. Dalle F, Lopez J, Caillot D, Cuisenier B,Ecarnot LA, Dumont L, et al. False-positive results caused by cotton swabs incommercial Aspergillus antigen latex agglutination test. European journal ofclinical microbiology & infectious diseases : official publication of theEuropean Society of Clinical Microbiology 2002; 21: 130-2.
20. Girmenia C, Ballaro D, Martino P.Contamination by cardboard particles as a cause of false-positive results forAspergillus galactomannan enzyme immunoassays. Clinical and vaccine immunology: CVI 2007; 14: 929.

 官方账号
官方账号