前言
2015年WHO数据统计,印度尼西亚和中国结核发病人数占全球的10%,我国成为结核发病的第二大国[1]。结核常会合并真菌感染,导致疾病的进一步恶化,引起高死亡率[2]。本文旨在探讨结核合并慢性肺曲霉病(CPA)的流行病学、发病机制及曲霉IgG抗体检测的临床意义,为减少结核合并CPA漏诊提供临床依据。
一、结核合并CPA的流行病学调查
结核是CPA主要的基础疾病之一[3-4]。据估计,结核合并的CPA全球患病人数为120万以上。经回顾及建模分析,预计结核合并CPA每年新增发病数达6万以上,5年期患病人数达20万以上,占CPA总患病人数约80%[5]。2015年伊朗的一篇研究显示124位结核患者中,13.7%的患者同时感染CPA[4]。结核后五年期CPA患病率估计为117万例,患病率达到18%[5]。2018年的一篇研究显示496例CPA患者中,有57%(267例)患有结核[6]。近期朝阳医院发表的研究也显示70例CPA患者中,患有结核的患者占35.7%(25例)[7]。CPA往往发病隐匿,短期内致死率能达到20-33%,未经干预时死亡率可达50%以上[5,8]。
二、结核容易合并CPA的发病机制
结核患者容易合并CPA的发病机制主要包括以下几点:
1、抗结核药物治疗疗程长,部分抗结核药属于广谱抗生素,可能是导致菌群失调、真菌感染的原因;
2、肺组织结构的破坏、支扩、空洞为曲霉菌提供定植繁殖的场所;
3、吞噬细胞和中性粒细胞功能的降低可增加曲霉病的风险;
4、结核病的免疫是T细胞介导的细胞免疫。Th1、Th2细胞协调平衡,在抗结核中发挥重要作用,细胞免疫功能受损增加了肺结核合并曲霉病的几率[9]。
三、结核和CPA具有相似的临床表现和影像学特征
CPA患者最常见的临床表现包括:体重减轻,慢性咳嗽,严重程度不一的咯血,疲劳和/或呼吸短促[10],偶尔会发生发烧和盗汗。影像学表现主要包括:肺曲霉球;空洞、小空洞、空洞周围浸润增多或纤维化增加;结节影;肺叶的严重纤维性结构破坏,进行性实变伴“脓肿形成”等[8]。
由于CPA与结核有相似的临床表现和影像学特征,难以早期诊断,及时治疗,寻找有效的诊断方法显得极为重要。
四、曲霉IgG抗体检测可用于结核患者CPA的诊断
美国传染病学会(IDSA)曲霉病指南和欧洲呼吸学会与临床微生物与传染病学会(ERS/ESCMID)CPA指南均明确指出曲霉IgG抗体水平升高是CPA诊断的必要依据之一。该方法是最敏感的微生物学方法[8,11],特异性近100%[12],误诊率低。一项来自英国的包含241例CPA患者和100例健康人血清样本的大型研究结果表明,曲霉IgG抗体试剂盒检测CPA,AUC值为0.902-0.996,敏感性为75-96%,特异性为97-99%[12](图一)。2015年Rita Oladele发表的一篇poster显示,涂阴肺结核或肺结核治疗失败的病人中约30%呈曲霉IgG抗体检测阳性。2018年的一篇结核合并CPA的研究指出,对排除复发性结核,并且曲霉特异性IgG抗体水平升高,影像学发生病变,伴有咳嗽或咯血的结核患者,可以认为合并CPA感染[13]。
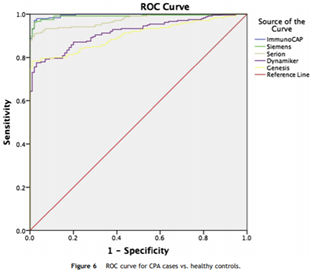
图一:曲霉IgG抗体试剂盒诊断CPA的ROC曲线
结后语
为减少结核合并CPA的漏诊,对肺部影像学发生改变或抗痨疗效不佳的结核患者,建议进行曲霉IgG抗体检测判断是否合并CPA,做到早期诊断,早期治疗!
参考文献
1 Goals MD, Goals SD, Strategy STB, Strategy ETB, Mdg T, Tb H, et al.gtbr2015_executive_summary WHO 2015 REPORT
2 Aghili S R, Shokohi T, Hedayati M T, et al. Invasive forms of Candida and Aspergillus in sputum samples of pulmonary tuberculosis patients attending the tuberculosis reference laboratory in Ghaemshahr, Northern Iran: An analysis of samples collected during the past 10 years[J]. International journal of mycobacteriology, 2016, 5: S179-S180.
3 Smith NL, Denning DW: Underlying conditions in chronic pulmonary aspergillosis including simple aspergilloma. Eur Respir J 2011, 37:865-872.
4 Hedayati MT, Azimi Y, Droudinia A, Mousavi B, Khalilian A, Hedayati N, Denning DW: Prevalence of chronic pulmonary aspergillosis in patients with tuberculosis from Iran. Eur J Clin Microbiol Infect Dis 2015, 34:1759-1765.
5 Denning DW, Pleuvry A, Cole DC: Global burden of chronic pulmonary aspergillosis as a sequel to pulmonary tuberculosis. Bull World Health Organ 2011, 89:864-872.
6 Zhan M, Xu B, Zhao L, et al. The Serum Level of IL-1B Correlates with the Activity of Chronic Pulmonary Aspergillosis[J]. Canadian respiratory journal, 2018, 2018.
7 Guo Y, Bai Y, Yang C, et al. Evaluation of Aspergillus IgG, IgM antibody for diagnosing in chronic pulmonary aspergillosis: A prospective study from a single center in China[J]. Medicine, 2019, 98(16).
8 Denning D W, Cadranel J, Beigelman-Aubry C, et al. Chronic pulmonary aspergillosis: rationale and clinical guidelines for diagnosis and management[J]. European Respiratory Journal, 2016, 47(1): 45-68.
9 Sun Z, Zhu P, Li L, et al. Adoptive immunity mediated by HLA-A* 0201 restricted Asp f16 peptides-specific CD8+ T cells against Aspergillus fumigatus infection[J]. European journal of clinical microbiology & infectious diseases, 2012, 31(11): 3089-3096.
10 Denning D W, Pleuvry A, Cole D C. Global burden of chronic pulmonary aspergillosis as a sequel to pulmonary tuberculosis[J]. Bulletin of the World Health Organization, 2011, 89: 864-872.
11 Patterson T F, Thompson G R, Denning D W, et al. Practice guidelines for the diagnosis and management of aspergillosis: 2016 update by the Infectious Diseases Society of America[J]. Clinical Infectious Diseases, 2016, 63(4): e1-e60.
12 Page I D, Richardson M D, Denning D W. Comparison of six Aspergillus-specific IgG assays for the diagnosis of chronic pulmonary aspergillosis (CPA)[J]. Journal of Infection, 2016, 72(2): 240-249.
13 Page I D, Byanyima R, Hosmane S, et al. Chronic pulmonary aspergillosis commonly complicates treated pulmonary tuberculosis with residual cavitation[J]. European Respiratory Journal, 2019, 53(3): 1801184.

 官方账号
官方账号