2020年1月30日武汉金银潭医院专家在《柳叶刀》杂志发表文章《Epidemiological and Clinical Characteristics of 99 Cases of 2019-Novel Coronavirus (2019-nCoV) Pneumonia in Wuhan, China》,本次研究为回顾性分析,研究对象为2020年1月1日至1月20日以病毒核酸RT-PCR方法或NGS确诊后在武汉金银潭医院接受治疗的患者,本研究针对99例新型冠状病毒(2019-nCoV)肺炎患者的流行病学和临床特征分析总结。
临床特征分析表明,99例患者中男性占了多数,共67名(68%),这一比例与之前报道的41例病例的数据(73%)一致;此次99例患者年龄最小的21岁,最大的82岁,平均年龄为55.5岁,较先前报道的49.0岁有所上升;在这99例患者中,有50名患者具有心血管疾病、内分泌系统疾病或消化系统疾病等慢性基础疾病,占比约为51%。这些基础疾病可能导致宿主免疫系统的缺损;提示各年龄段都可发病,既往有合并症的中老年患者更易感新型冠状病毒[1]。
重要的是该研究首次描述了2019-nCoV肺炎患者合并细菌和真菌感染的现状。本次研究对99例患者进行了9种呼吸道病原体检测,A型和B型流感病毒核酸检测和细菌、真菌培养。结果显示99例患者未发现其它呼吸道病毒感染。细菌、真菌培养结果显示,其中1例患者为鲍曼不动杆菌、肺炎克雷伯菌合并黄曲霉感染。1例患者为光滑念珠菌感染,3例患者为白念珠菌感染。见图1。
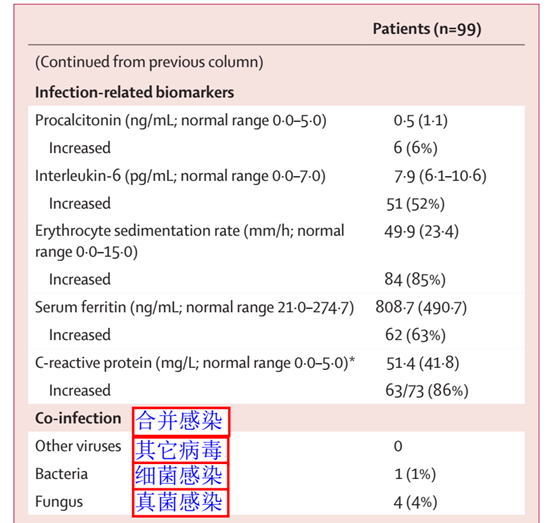
图1 2019-nCoV肺炎患者实验室检测结果
鉴于这99例病例报告,2019-nCoV肺炎患者合并真菌感染的发病率较细菌更高。这可能与文章提及的治疗方案相关,文中总结约四分之三的患者(76%)接受了抗病毒疗法。患者使用的药物包括奥司他韦(oseltamivir)、更昔洛韦(ganciclovir)、以及最近引起广泛关注的抗HIV感染疗法洛匹那韦/利托那韦(lopinavir/ritonavir)。总体治疗方案仍为抗病毒同时预防合并细菌或真菌感染。其中,70%的患者接受了抗生素治疗,15%的患者接受了抗真菌治疗。这反映了临床医生对患者抗感染治疗的重视程度。在28日发表的新型冠状病毒诊疗方案(第四版)中指出:需要避免盲目或不恰当使用抗菌药物,因此加强细菌和真菌感染诊断的微生物学证据就显得尤为重要。
然而,就目前的研究证实,真菌培养的敏感性并不高,血培养是念珠菌血症诊断的“金标准”,但血培养花费时间较长,通常需要3-7天,敏感性为21%-71%,存在相当程度的漏诊率[2]。真菌培养对诊断曲霉感染的敏感性并不高,并且取决于检测人群。在最近的研究,移植受者侵袭性曲霉感染患者,其组织培养结果阳性只有25%-50%[3-4]。因此,本研究中对新型冠状病毒肺炎患者合并感染检测只采用培养法,不排除99例患者存在真菌感染漏诊的可能。
近年来,血清学和分子诊断在侵袭性真菌病诊断中受到认可,荷兰鹿特丹大学的回顾性队列研究中,作者通过培养法和曲霉半乳甘露聚糖(GM)试验对83例重症流感合并侵袭性肺曲霉病(IPA)患者进行检测。其中,80例患者取肺泡灌洗液(BALF)进行培养,有50例(63%)呈曲霉培养阳性,对76例患者进行BALF GM试验,有67例(88%)呈阳性,对31例患者进行了血清GM试验,有20例(65%)呈阳性[5]。荷兰的一项多中心回顾性研究显示18例重症流感合并IPA患者中,BALF培养敏感性为78%,而BALF GM试验敏感性高达94%,血清GM检测敏感性为64%-71%[6]。
与此同时,曲霉半乳甘露聚糖IgG抗体也可用于检测侵袭性曲霉病,根据患者自身免疫情况的不同,曲霉半乳甘露聚糖IgG抗体检测的敏感性为29%-100%[7]。针对侵袭性念珠菌感染,念珠菌甘露聚糖抗原和抗体检测也受到国内外指南推荐。国外研究报道,念珠菌甘露聚糖抗原检测的敏感性为58%、特异性为93%,抗甘露聚糖抗体的敏感性59 %,特异性为83%。当甘露聚糖抗原和抗体联合检测可提高敏感性为83%,特异性为86%[8]。另外,分子诊断PCR检测在IA的敏感性和特异性分别在84%-94.1%和73.3%-98.6%[9-14]。以上结果显示,血清学和分子诊断检测敏感性高于传统培养法,同时检测周期大大短于培养法,更有利于疾病的早期诊断。
同时,本研究发现2019nCoV可能与SARSCoV发病机制一样主要作用于淋巴细胞,尤其是T淋巴细胞。病毒颗粒通过呼吸道粘膜扩散并感染其他细胞,在体内诱发细胞因子风暴,产生一系列免疫反应。一些患者呼吸窘迫综合征(ARDS)和败血性休克进展迅速,最终导致多器官功能衰竭。因此,早期识别和及时处理危重病例至关重要。文中指出:“SARS的死亡率超过10%,MERS-CoV的死亡率超过35%,而本次观察性研究中的死亡率为11%”。参考2003年SARS爆发的情况看,真菌感染是SARS患者死亡的重要原因,占所有死因的25%-73.7%[15-17] 。
文末作者指出对于严重的混合感染,除了病原体的致病因素外,宿主的免疫状况也是重要因素之一。老年,肥胖和合并症可能与死亡率增加相关。当免疫功能低下的人群,例如老年人,糖尿病患者,HIV患者,长期使用免疫抑制剂的人群和孕妇感染2019nCoV时,应及时使用抗生素预防感染可以减少并发症和死亡率。
2019nCoV肺炎合并真菌感染现状严峻,应给予高度重视和警惕,应采取早期、联合、快速精准诊断,实现早期治疗,提升患者的生存率!
鉴于此,新型冠状病毒感染患者推荐早期进行真菌联合检测,筛查方案如下:
1、怀疑侵袭性曲霉感染的患者推荐:
G试验+曲霉半乳甘露聚糖(GM)+曲霉半乳甘露聚糖IgG抗体+曲霉多重PCR
2、怀疑侵袭性念珠菌感染的患者推荐:
G试验+念珠菌甘露聚糖(Mn)+念珠菌甘露聚糖IgG抗体+念珠菌多重PCR
3、怀疑侵袭性隐球菌感染的患者推荐:
隐球菌荚膜多糖抗原检测(GXM)
4、怀疑侵袭性真菌感染的患者推荐:
5G+真菌联合检测方案,即:G试验+曲霉半乳甘露聚糖(GM)+曲霉半乳甘露聚糖IgG抗体+ 念珠菌甘露聚糖(Mn)+念珠菌甘露聚糖IgG抗体+隐球菌荚膜多糖抗原检测(GXM),可选:曲霉多重PCR+念珠菌多重PCR
附录:真菌联合检测项目简介
G试验:(1-3)-β-D葡聚糖存在于除接合菌和隐球菌以外的真菌细胞壁中,占真菌细胞壁成分的50%以上,在酵母菌中的含量最高,其他微生物,动物及人的细胞均不含该成分,是真菌细胞壁上的特有成分,成为真菌的分子标志物。
曲霉半乳甘露聚糖(Galactomannan, GM):是曲霉菌细胞壁的主要成分,被认为是曲霉菌感染后最早释放入血的标志性抗原,其释放量与菌量成正比,可以反映感染程度,主要用于检测侵袭性曲霉病。
曲霉半乳甘露聚糖IgG 抗体检测:是机体对曲霉感染后出现的特异性免疫反应,使用曲霉半乳甘露聚糖IgG 抗体检测有助于慢性肺曲霉病(CPA)患者临床诊断,具有重要临床意义。
曲霉实时PCR检测:是一种对全血、血浆、血清、支气管肺泡灌洗液(BALF)中提取的曲霉DNA进行定性检测的多重实时PCR体外试验。本项目基于多重实时荧光定量检测技术,设计独立特异性的引物与探针体系,建立一种同时能够检测四种临床常见致病曲霉的方法,其中包括烟曲霉、黄曲霉、土曲霉、黑曲霉,并对烟曲霉和土曲霉进行单独区分鉴定。
念珠菌甘露聚糖(Mannan, Mn):是念珠菌感染的标志物已被广泛研究。甘露聚糖常以糖蛋白的形式存在于多种微生物中,是念珠菌表面除葡萄糖外的另一重要抗原,用于检测侵袭性念珠菌病。
念珠菌甘露聚糖IgG抗体检测:是机体对念珠菌感染后出现的特异性免疫反应,使用念珠菌甘露聚糖IgG 抗体检测有助于念珠菌感染患者临床诊断,具有重要临床意义。
念珠菌实时PCR检测:是一种对全血、血浆或血清中提取的念珠菌DNA进行定性检测的多重实时PCR体外试验。本项目基于多重实时荧光定量检测技术,设计独立特异性的引物与探针体系,建立一种同时能够检测五种临床常见致病念珠菌的法,其中包括白念珠菌、热带念珠菌、克柔念珠菌、光滑念珠菌、近平滑念珠菌,并对天然耐药的克柔念珠菌和光滑念珠菌进行单独区分鉴定。
隐球菌荚膜多糖(Glucuronoxylomannan, GXM)检测:可用于侵袭性隐球菌感染辅助诊断,隐球菌病是条件致病性深部真菌病,引起人类感染的隐球菌主要为新型隐球菌和格特隐球菌,进入人体后很快形成厚荚膜,致病力增强。
参考文献
[1] Chen N, Zhou M, Dong X, et al. Epidemiological and Clinical Characteristics of 99 Cases of 2019-Novel Coronavirus (2019-nCoV) Pneumonia in Wuhan, China[J]. 2020.
[2]Clancy CJ, Nguyen MH: Finding the "missing 50%" of invasive candidiasis: How nonculture diagnostics will improve understanding of disease spectrum and transform patient care. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 2013;56:1284-1292.
[3] Neofytos D, Horn D, Anaissie E, et al. Epidemiology and outcome of invasive fungal infection in adult hematopoietic stem cell transplant recipients: analysis of Multicenter Prospective Antifungal Therapy (PATH) Alliance registry[J]. Clinical Infectious Diseases, 2009, 48(3): 265-273.
[4] Kontoyiannis D P, Marr K A, Park B J, et al. Prospective surveillance for invasive fungal infections in hematopoietic stem cell transplant recipients, 2001–2006: overview of the Transplant-Associated Infection Surveillance Network (TRANSNET) Database[J]. Clinical Infectious Diseases, 2010, 50(8): 1091-1100.
[5]Schauwvlieghe A F A D, Rijnders B J A, Philips N, et al. Invasive aspergillosis in patients admitted to the intensive care unit with severe influenza: a retrospective cohort study[J]. The Lancet Respiratory Medicine, 2018, 6(10): 782-792
[6]Van De Veerdonk F L, Kolwijck E, Lestrade P P A, et al. Influenza-associated aspergillosis in critically ill patients[J]. American Journal of Respiratory and Critical Care Medicine, 2017, 196(4): 524-527.
[7]Ullmann A J,Aguado J M,Arikan-Akdagli S, et al. Diagnosis and management of Aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline.[J].Clinical microbiology and infection : the official publication of the European Society of Clinical Microbiology and Infectious Diseases,2018,24 Suppl 1.
[8] Ahmad S, Khan Z: Invasive candidiasis: A review of nonculture-based laboratory diagnostic methods. Indian journal of medical microbiology 2012;30:264-269.
[9] Chong G L M, van de Sande W W J, Dingemans G J H, et al. Validation of a new Aspergillus real-time PCR assay for direct detection of Aspergillus and azole resistance of Aspergillus fumigatus on bronchoalveolar lavage fluid[J]. Journal of clinical microbiology, 2015, 53(3): 868-874.
[10] Chong G M, van der Beek M T, Von dem Borne P A, et al. PCR-based detection of Aspergillus fumigatus Cyp51A mutations on bronchoalveolar lavage: a multicentre validation of the AsperGenius assay® in 201 patients with haematological disease suspected for invasive aspergillosis[J]. Journal of Antimicrobial Chemotherapy, 2016, 71(12): 3528-3535.
[11] Orsi C F, Bettua C, Pini P, et al. Detection of Pneumocystis jirovecii and Aspergillus spp. DNA in bronchoalveolar lavage fluids by commercial real-time PCR assays: comparison with conventional diagnostic tests[J]. New Microbiol, 2015, 38(1): 75-84.
[12] BÖLÜK G, Kazak E, ÖZKALEMKAŞ F, et al. Comparison of galactomannan, beta-D-glucan, and Aspergillus DNA in sera of high-risk adult patients with hematological malignancies for the diagnosis of invasive aspergillosis[J]. Turkish journal of medical sciences, 2016, 46(2): 335-342.
[13] Bhaskaran A, Kabbani D, Singer L G, et al. (1, 3) β-D-Glucan in bronchoalveolar lavage of lung transplant recipients for the diagnosis of invasive pulmonary aspergillosis[J]. Medical mycology, 2017, 55(2): 173-179.
[14] Zhao Y, Garnaud C, Brenier-Pinchart M P, et al. Direct molecular diagnosis of aspergillosis and CYP51A profiling from respiratory samples of French patients[J]. Frontiers in microbiology, 2016, 7: 1164.
[15] 魏嘉平, 王香平, 张建, 等. 19 例 SARS 死亡病例临床分析[J]. 首都医科大学学报, 2003, 24(4): 374-379.
[16] 刘惠媛,石裕明.12例SARS患者死亡危险因素分析[J].中国危重病急救医学,2003(09):526-528.
[17] 肖正伦, 袁锦萍, 吴礼襄, 等. 严重急性呼吸综合征继发细菌和真菌感染的临床研究[D]. , 2004(01):15-16.

 官方账号
官方账号